【培训笔记】牙膏备案 · 药监局高研院培训 1
本文转载自妆规情报局微信公众号,原文链接:https://mp.weixin.qq.com/s/av7A8k2SbQhMyBnlRUL5QQ
12.20-12.21国家药品监督管理局高级研修学院组织《牙膏备案工作专题培训班》。首日培训笔记:
基本要求
1. 什么是“牙膏”?
ISO 11609: 2017:
Toothpaste: Any semi-solid dentifrice preparation presented in the form of a paste, cream or gel.
GB/T 8372-2017:
牙膏:由摩擦剂、保湿剂、发泡剂、芳香剂、水和其他添加剂(含用于改善口腔健康状况的功效成分)为主要原料混合组成的膏状物质。
《牙膏监督管理办法》:
本办法所称牙膏,是指以摩擦的方式,施用于人体牙齿表面,以清洁为主要目的的膏状产品。
关键点:摩擦、牙齿表面、主要清洁、膏状。
液体牙膏?摩丝?
X 冰硼乳膏是药品,不是牙膏。
2. 牙膏中的主要成分有哪些?
一般牙膏的构成成分有水,香精,发泡剂,增稠剂,保湿剂,摩擦剂,抗氧化剂,味觉改良剂,外观改良剂,防腐剂,酸碱缓冲剂,功效成分等。其中核心成分为摩擦剂。

3. 牙膏允许宣称的功效有哪些?
功效上牙膏可分为以下两个大类:
❑ 普通牙膏:基础清洁功效,包括清洁口腔、减少软垢、保持口腔卫生,清新口气等。
❑ 功效牙膏:普通牙膏中加入功效成分的牙膏。功效牙膏的功效包括防龋、抑牙菌斑、抗牙本质敏感、减轻牙龈问题、美白、抗牙石、减轻口臭以及其他功效。【注意,此处功效分类出自轻工业行业标准QB/T 2966—2014《功效型牙膏标准》】
而现行牙膏分类编码中的功效维度仅包含5大类:基础清洁、防龋、抑牙菌斑、抗牙本质敏感、减轻牙龈问题。针对美白、抗牙石、减轻口臭,建议尽可能往这5类机理中靠。例如减轻口臭,企业需从机理上去考虑如何实现,如果本质上就是通过清洁实现口气清新,那就可以分类上归为清洁功效。再比如美白,简化备案中不少产品宣称美白,但也是通过“清洁”实现的,那么也是可以归为清洁分类。但“美白”这个词,建议大家后续着重关注具体法规实施的认可性。
4. 牙膏上市/进口前是否需要备案证?
牙膏已于今年12月1日起正式实施备案管理。产品上市/进口前应完成备案,获取备案凭证。
5. 已简化备案的产品,如若已上市的原包装不合规,是否需要下架召回?
针对这种情形现阶段还没有非常明确的监管要求,但如果是有明显违规宣称(重点涉医疗术语)的,建议企业召回,否则也可能受到市场举报投诉。
企业主体
1. 境外企业如何申报牙膏备案?
境外企业需要委托一个境内的企业法人作为境内责任人。要注意是企业法人,不可以是自然人个体、也不可以是院校、口腔医院等。境内责任人负责办理备案,并且协助开展召回、不良反应监测与其他配合监督管理工作。
2. 备案人的主要责任义务有哪些?
❑ 对质量安全负责(建立生产质量管理体系、对牙膏原料安全性负责等)
❑ 对功效宣称负责(在特定平台公布功效宣称的依据,接受公众监督)
备案管理
1. 在哪里提交备案信息?
❑ 国产牙膏
1)20个省市:
https://hzpba.nmpa.gov.cn/
20个省市包括:北京、天津、河北、山西、内蒙古、辽宁、吉林、黑龙江、上海、江苏、浙江、安徽、福建、江西、山东、河南、湖北、湖南、广西、海南、重庆、四川、贵州、云南、西藏、陕西、甘肃、新疆、新疆生产建设兵团。
2)广东省:
https://mpa.gd.gov.cn/portalEp/
❑ 进口牙膏
https://hzpba.nmpa.gov.cn/
2. 国产牙膏和进口牙膏备案资料有哪些差异?
首先牙膏备案都需要提供以下八个大类资料:
(一)备案人的名称、地址、联系方式;
(二)生产企业的名称、地址、联系方式;
(三)产品名称;
(四)产品配方;
(五)产品执行的标准;
(六)产品标签样稿;
(七)产品检验报告;
(八)产品安全评估资料。
进口牙膏还需额外提供在海外已经上市销售的证明文件。但如果进口牙膏是专门为中国市场设计,还未上市的,在不提供海外上市销售证明的情况下,需要补充面向我国消费者开展的研究资料。
以及进口牙膏所涉及到的境外工厂,无法提供我国的生产许可证,则需要提供符合化妆品生产质量管理规范的证明文件,例如GMP良好生产规范证书。
儿童牙膏
1. 小金盾是否适用于儿童牙膏?
是的,特定宣称儿童使用、可用,或者全家适用等暗示儿童可用产品,需要参照儿童牙膏(化妆品)标准管理,产品标签上要标注小金盾。注意要将小金盾标志中的“儿童化妆品”改为“儿童牙膏”。

2. 儿童牙膏可以宣称功效吗?
可以,但除清洁功能外,只可以宣称防龋。
原料管理
1. 什么是牙膏新原料?
在我国境内首次使用于牙膏的天然或者人工原料为牙膏新原料。参照化妆品的判断方式,可通过《已使用的牙膏原料目录》(尚未正式发布)进行判断。一般情况下,未列入目录中的为新原料。新原料需先经过注册备案,才能在产品中使用。

2. 新原料注册备案后,所有企业都可以使用了吗?
不是,新原料刚注册备案后,仅新原料的申请人及授权方可使用该新原料。已注册备案经过“3年安全监测期”,没有发生安全问题的新原料则会被纳入《已使用的牙膏原料目录》,开发使用。但注意使用时需要满足该新原料的技术要求。
3. 非新原料的牙膏使用有什么要求?
目前国内对牙膏原料管理最细致的一个标准是《GB 22115-2008 牙膏用原料规范》。标准中主要有三个禁用组分表、限用组分表和准用防腐剂、准用着色剂。但此标准已有些年头,最初所依据的欧盟化妆品法规也已在不断更新,药监局或将启动该标准的更新。一般而言,标准的制定也会综合参考以下相关法规或文件的清单管理,建议企业在日常产品开发过程中可以提前综合考虑。
《化妆品安全技术规范》、《已使用化妆品原料目录》、《欧盟化妆品法规》、其他:《国际化妆品原料标准中文名称目录(2010年版)》、《中国药典(2010年版)》、《中国植物志》、欧盟和美国数据库、食品安全标准等。
备案检验
1. 哪些检验机构可以做牙膏备案检验?
备案检验项目(微生物、理化、毒理和人体)
❑ 化妆品注册和备案检验机构(共380+家)注意要检查机构的《取得资质认定的检验项目》是否覆盖牙膏检验项目。
毒理学
❑ 药物非临床安全性评价研究机构(GLP机构-共66家)
人体功效试验
❑ 药物临床试验机构和/或医疗器械临床试验机构(具有口腔科目的医疗机构执业资格)(以预防口腔科为例:药物GCP-共12家;医疗器械GCP-共1364家)
2. 企业自己做的检验报告可接受吗?
参考国家药监局关于优化普通化妆品备案检验管理有关要求,符合相关要求的,牙膏备案人可自行或委托受托生产企业按照要求进行相关微生物和理化检验。且备案人应当同时提交:具备相应检验能力的声明;开展自检的相应检验人员、设备设施和场所环境等情况说明;承诺对报告的真实性、准确性负责。
3. 检验项目有哪些?
❑ 微生物和理化检验
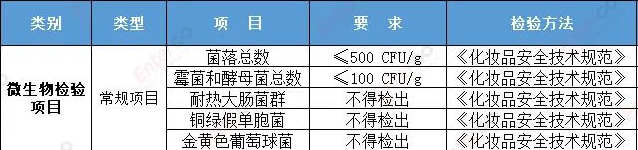
1. 微生物检验项目
2. 理化常规项目

3. 根据产品配方选择的检验项目

❑ 毒理学试验
《牙膏备案资料管理规定》(以下简称《规定》)提出生产企业取得相关资质认证且安全风险评估结果能够充分确认产品安全性的,部分牙膏产品可免于提交口腔黏膜刺激试验报告。同时,以安全为底线,结合牙膏的使用特点和我国产品特点,经充分研究和广泛征求意见《规定》提出了不可免相关试验的情形:
a.产品宣称儿童使用的;
b.产品宣称具有防龋、抑牙菌斑、抗牙本质敏感、减轻牙龈问题功效的;
c.产品使用尚在安全监测中新原料的。
调研数据来看,牙膏的毒理学试验时长4~8周,收费为0.4~1.1万元。
4. 国外的检验报告可以用于产品备案吗?
5. 哪些功效要进行人体试验?
《规定》要求牙膏宣称具有防龋、抑牙菌斑、抗牙本质敏感、减轻牙龈问题等功效,需进行人体功效评价 。
6. 人体功效检验一定要找医院做吗?
人体功效需在具有GCP资质的机构进行。